February 2022 (بهمن 1400)
ژن های متفاوت مؤثر در بروز اختلال اٌتیسم، اثرات یکسانی بر رشد مغز دارند
محققان از مدل های سه بعدی و مینیاتوری مغز انسان جهت پیشبرد درک بیماری ها استفاده می کنند.
اختلال طیف اوتیسم با صدها ژن متفاوت مرتبط است، اما اینکه چگونه این جهش های ژنتیکی متفاوت منجر به آسیب شناسی مشابه در بیماران مبتلا می شوند، هنوز به صورت معما باقی مانده است. اکنون محققان دانشگاه هاروارد و موسسه Broad دانشگاه MIT دریافتهاند که سه ژن متفاوت در افزایش خطر بروز اختلال اتیسم در واقع بر جنبههای مشابه شکلگیری بافت عصبی و انواع یکسانی از نورونها در مغز انسان در حال رشد، تأثیر میگذارند. با آزمایش جهشهای ژنتیکی در مدلهای سه بعدی مینیاتوری مغز انسان به نام «ارگانوئیدهای مغز»، محققان نقایص کلی مشابهی را برای هر ژن پرخطر شناسایی کردند. اگرچه هر یک از آنها از طریق مکانیسمهای مولکولی زیربنایی منحصر بفردی عمل میکردند.
نتایج این مطالعه که در مجله ی Nature منتشر شده است و به محققان درک بهتری از اختلال طیف اٌتیسم داده و می تواند اولین گام برای یافتن درمان اتیسم و بهبود علایم آن باشد. در این زمینه تمرکز به درک و فهم این موضوع اختصاص داده شده که آیا اشتراکاتی در میان ژنهای پرخطر مرتبط با اٌتیسم وجود دارد یا خیر؟ یافتن چنین ویژگی های مشترک می تواند اهداف مشترک را برای مداخله ی درمانی گسترده، مستقل از منشاء ژنتیکی بیماری فراهم نماید. یافته ها نشان میدهند که جهشهای متفاوت در این اختلال در واقع بر روی سلولها و فرآیندهای رشدی مشابه از طریق مکانیسمهای متمایز تأثیر میگذارند .پرفسورPaola Arlotta نویسنده ارشد این مقاله، استاد گروه زیست شناسی و سلول های بنیادی در دانشگاه هاروارد و عضو مرکز تحقیقات روانپزشکی Stanley در موسسهBroad دانشگاه MIT اظهار میدارد:” این نتایج، تحقیقات آتی در زمینه ی رویکردهای درمانی با هدف تعدیل ویژگی های مشترک ناکارآمد مغز را هدایت خواهد کرد.”
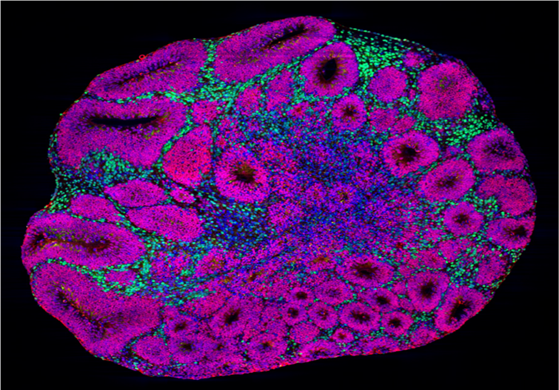
تحقیق در آزمایشگاه پرفسور Arlotta بر روی مدلهای ارگانوئیدی قشر مغز انسان، بخشی از مغز که مسئول شناخت، ادراک و گفتار است، تمرکز دارد. این مدلها در ابتدا از سلولهای بنیادی مشتق شده و سپس به یک بافت سه بعدی تمایز می یابند که حاوی انواع مختلف سلولهای قشر مغز است، از جمله نورونهایی که قادر به ارسال پیام و اتصال به مدارهای عصبی هستند.
دکتر Silvia Velasco کارشناس ارشد فوق دکترا در آزمایشگاه پرفسور Arlotta و یکی از نویسندگان ارشد مطالعه اخیر میگوید: “در سال 2019، ما روشی را معرفی کردیم که امکان تولید ارگانوئیدها را با توانایی منحصر به فرد برای رشد تکرارپذیر فراهم میکند. این ارگانوئید ها به طور مداوم همان نوع سلولها را به همان ترتیبی ایجاد میکنند که در قشر مغز انسان در حال رشد وجود دارد. اکنون که از ارگانوئیدها می توان برای کشف موارد غیرقابل پیش بینی و جدید در مورد اختلال پیچیده ای مانند اٌتیسم استفاده کرد، مانند آن است که رویایی به حقیقت پیوسته است.”
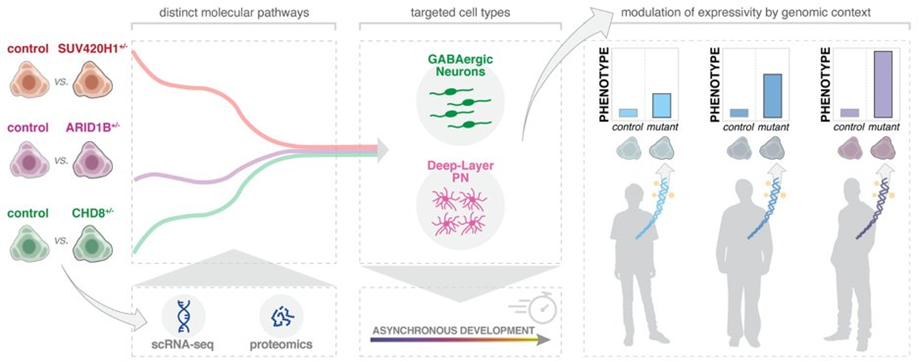
در این مطالعه، محققان ارگانوئیدهایی واجد جهش در یکی از سه ژن خطر اٌتیسم، SUV420H1، ARID1B و CHD8 ایجاد نمودند.
دکتر Bruna Paulsen یکی از همکاران فوق دکترا در آزمایشگاه Arlotta اظهار میدارد:” ما تصمیم گرفتیم با این سه ژن که عملکرد فرضی بسیار گسترده ای دارند شروع کنیم زیرا این ژن ها عملکرد کاملا روشن و مشخصی ندارند که به راحتی قادر به توضیح آنچه که در اختلال طیف اٌتیسم اتفاق می افتد، باشند. بنابراین ما علاقه مند شدیم که دریابیم، آیا این ژن ها به نحوی واجد عملکرد مشابهی میباشند یا خیر.”
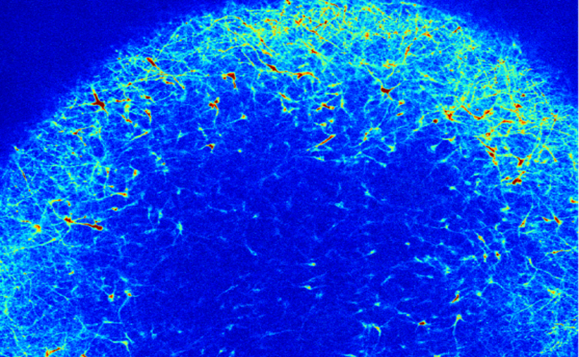
محققین ارگانوئیدها را در طی چند ماه رشد دادند و مراحل شکل گیری قشر مغز انسان را مدل سازی کردند. آنها سپس ارگانوئیدها را با استفاده از چندین نوع فناوری، مورد تجزیه و تحلیل قرار دادند از جمله توالی یابی RNA تک سلولی و توالی یابی ATAC تک سلولی برای اندازه گیری تغییرات و تنظیم بیان ژن ناشی از هر جهش غیر طبیعی، پروتئومیکس برای اندازه گیری پاسخ پروتئین ها و تصویربرداری از کلسیم برای بررسی اینکه آیا تغییرات مولکولی در فعالیت غیر طبیعی نورون ها و شبکه های آنها منعکس شده است یا خیر.
Joshua Levin یکی از نویسندگان و دانشمند دیگر موسسه Stanley و مرکز سلولی Klarman در موسسهBroad میگوید: “این مطالعه تنها با همکاری چندین آزمایشگاه با تخصص های خاص و منحصر بفرد، که برای بررسی این اختلال پیچیده از زوایای مختلف گرد هم آمدند، ممکن شد.”
محققان دریافتند که ژنهای پرخطر، همه نورونها را به روشی مشابه تحت تأثیر قرار میدهند که رشد و تکامل عصبی را تسریع و یا کند مینمایند. به عبارت دیگر، نورون ها در زمان نامناسبی رشد میکنند. البته لازم به ذکر است که همه سلولهای نورونی تحت تأثیر قرار نمیگیرند بلکه، ژنهای پرخطر بر دو جمعیت سلولی نورونی تأثیر میگذارند، یک نوع آن از انواع سلول های مهارکننده بوده، بنام نورونهای GABAergic و نوع دیگراز انواع سلول های تحریککننده به نام نورونهای برونفکنی تحریکی لایه عمقی میباشند که این مطلب خود به انتخابی بودن سلولهای درگیر اشاره میکند که ممکن است اهداف ویژه در اختلال اٌتیسم باشند.
دکتر Martinai Pigonمحقق فوق دکترا در آزمایشگاه Arlotta و یکی از نویسندگان ارشد مقاله میگوید:” قشر مغز به روشی بسیار هماهنگ ساخته شده است، به نحوی که هر نوع سلول نورونی در یک زمان مشخص ظاهر می شود و خیلی سریع آغاز به ایجاد اتصالات عصبی می کنند، اگر برخی سلولها زودتر و یا دیرتر در مقایسه با زمانی که قرار است تشکیل شوند، ایجاد گردند ممکن است این امر در نهایت باعث تغییر نحوه اتصالات در مدارهای عصبی شود.
محققان علاوه بر بررسی و آزمایش ژنهای مختلف پرخطر، ارگانوئیدهایی را نیز با استفاده از سلولهای بنیادی افراد اهدا کننده تولید کردند. خانم Amanda Kedaigle زیستشناس بیوانفورماتیک آزمایشگاه Arlotta و یکی از نویسندگان این مقاله اظهار میدارد: “هدف ما این بود که بررسی کنیم چگونه تغییرات موجود در ارگانوئیدها ممکن است تحت تأثیر زمینه ژنتیکی منحصر بفرد، شخص قرار گرفته باشد.”
هنگامی که ارگانوئیدهای ساخته شده از اهداکنندگان مورد بررسی قرار داده شد، اگر چه تغییرات کلی در زمینه رشد عصبی مشابه هم بود، اما میزان شدت آن در افراد مختلف متفاوت بود.که نشانگر این مطلب است که اثرات ژن های پرخطر توسط ژنوم اهدا کننده به خوبی تنظیم شده بود .
در واقع این یک معما است که چگونه جهش های ژنی پرخطر یکسان ،در اختلال اٌتیسم اغلب تظاهرات بالینی و علایم اتیسم متغیری را در بیماران مبتلا نشان می دهند.
دکتر Arlotta گفت: “دریافتیم که زمینههای متفاوت ژنومی انسان میتواند تظاهرات فنوتیپی بیماری را در ارگانوئیدها تعدیل نماید. بدین ترتیب ممکن است در آینده بتوانیم با استفاده از ارگانوئیدها مشارکت های ژنتیکی متمایز را از هم جدا نموده و به درک کامل این آسیبشناسی پیچیده نزدیک شویم.”
مطالعات ژنتیکی در شناسایی تغییرات ژنومی مرتبط با اختلال طیف اٌتیسم و سایر اختلالات عصبی رشدی بسیار موفق بوده است.
پرفسور Steven Hyman استاد ممتاز سلولهای بنیادی و زیستشناسی دانشگاه هاروارد، مدیر موسسه Broad و یکی از اعضای اصلی موسسه Stanley میگوید: “گام دشوار بعدی در مسیر کشف روش های درمانی جدید این است که دقیقاً مشخص گردد که جهشهای ژنی با مغز در حال رشد چه میکنند. با نقشه برداری از تغییرات در مدارهای عصبی مغز در حضور جهش های ژنتیکی، میتوانیم گام بعدی را در جهت تشخیص بهتر اختلال برداشته و روش های جدیدی را برای اکتشافات درمانی جهت این اختلال بدست آوریم.
مترجم:دکتر هایده حائری
منبع:
:Story Source
Materials provided by Harvard University. Original written by Jessica Lau
:Journal Reference
Bruna Paulsen, Silvia Velasco, Amanda J. Kedaigle, Martina Pigoni, Giorgia Quadrato, Anthony J. Deo, Xian Adiconis, Ana Uzquiano, Rafaela Sartore, Sung Min Yang, Sean K. Simmons, Panagiotis Symvoulidis, Kwanho Kim, Kalliopi Tsafou, Archana Podury, Catherine Abbate, Ashley Tucewicz, Samantha N. Smith, Alexandre Albanese, Lindy Barrett, Neville E. Sanjana, Xi Shi, Kwanghun Chung, Kasper Lage, Edward S. Boyden, Aviv Regev, Joshua Z. Levin, Paola Arlotta. Autism genes converge on asynchronous development of shared neuron classes. Nature,2022
; DOI